Поскольку критические константы являются характеристическими свойствами газов, их можно использовать для создания соответствующей относительной шкалы, введя безразмерные приведенные переменные: приведенное давлениеpr(π), приведенный объем Vr(φ) и приведенную температуру Tr(τ):
![]() ;
;![]() ;
;![]() .
.
Соответственными называются состояния разных веществ, имеющие одинаковые значения приведенных переменных. Согласно закону соответственных состояний, если для рассматриваемых веществ значения двух приведенных переменных одинаковы, должны совпадать и значения третьей приведенной переменной. Таким образом, уравнения состояния различных веществ, записанные в приведенных переменных, должны совпадать. Это утверждение эквивалентно постулату о существовании общего универсального приведенного уравнения состояния: F(pr, Vr, Tr) = 0
Поскольку это приведенное уравнение не содержит в явном виде индивидуальных постоянных, оно должно быть применимо к любому веществу. Закон соответственных состояний является общим утверждением, не связанным с конкретным видом уравнения состояния. На практике закон соответственных состояний приближенно выполняется для однотипных веществ, что позволяет, например, использовать для реальных газов обобщенные диаграммы сжимаемости.
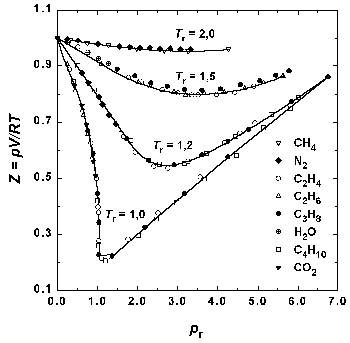
Рис.1.6. Зависимость фактора сжимаемости некоторых газов от приведенного давления при разных приведенных температурах.
Можно показать, что любое уравнение состояния, содержащее три параметра, можно представить в приведенной форме. Для тех из них, которые содержат три параметра, представлена также и приведенная форма. Отсутствие универсального уравнения F(pr, Vr, Tr) = 0 говорит не о неверности закона о соответственных состояниях, а о недостаточности двух индивидуальных постоянных и R в уравнении состояния.
В настоящее время понятно, почему в уравнениях состояния реальных газов двух индивидуальных параметров в общем случае не хватает, но в первом приближении этого достаточно. Причиной всех отклонений от уравнения состояния идеального газа являются межмолекулярные взаимодействия в газах.
Статистический расчет показывает, что наличие индивидуальных постоянных в уравнении межмолекулярного взаимодействия всегда приводит к появлению индивидуальных постоянных и в уравнении состояния газов. Поэтому в области значений p, V и T, для которых в реальных газах вклад межмолекулярных взаимодействий достаточно велик, в уравнениях состояния появляются индивидуальные постоянные, зависящие от параметров уравнении межмолекулярного взаимодействия. Поэтому в приближенных уравнениях состояния часто оказывается достаточно использовать две индивидуальные постоянные. Если же требуется описать поведение газа с более высокой точностью, необходимо использовать уравнения с бу льшим числом постоянных. Так, например, уравнение Битти – Бриджмена содержит пять постоянных кроме R и считается одним из лучших эмпирических уравнений состояния. В течение некоторого времени оно применялось при составлении справочных таблиц реальных газов. В настоящее время для возможно более точного описания свойств газов используют эмпирическое уравнение Бенедикта – Вебба – Рубина:
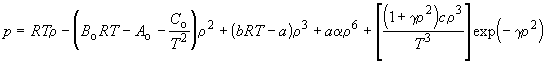
 Вблизи поверхности Земли ускорение свободного падения зависит ОТ широты местности. Это объясняется нешарообразностью формы Земли и влиянием суточного вращения Земли вокруг своей оси.
Вблизи поверхности Земли ускорение свободного падения зависит ОТ широты местности. Это объясняется нешарообразностью формы Земли и влиянием суточного вращения Земли вокруг своей оси.
 Законы физики основаны на фактах, установленных опытным путем.
Законы физики основаны на фактах, установленных опытным путем.
 Турбина 16 века использовавшая энергию движущейся воды, применялась для привода ирригационных насосов.
Турбина 16 века использовавшая энергию движущейся воды, применялась для привода ирригационных насосов.