Поведение газов, которые близки к конденсации, не описывается уравнением состояния идеального газа. Однако это уравнение можно усовершенствовать так, чтобы оно приближенно описывало не только свойства газа, но и свойства жидкости. Предпринималось множество попыток для учета отклонений свойств реальных газов от свойств идеального газа путем введения различных поправок в уравнение состояния идеального газа. Наибольшее распространение вследствие простоты и физической наглядности получило уравнение Иоханнеса Дидерика Ван-дер-Ваальса (1837 - 1923).
Первая поправка в уравнении состояния идеального газа рассматривает собственный объем, занимаемый молекулами реального газа. В уравнении Дюпре (1864): p(V – νb) = νRT, где постоянная b учитывает собственный мольный объем молекул.
При понижении температуры межмолекулярное взаимодействие в реальных газах приводит к конденсации (образование жидкости). Межмолекулярное притяжение эквивалентно существованию в газе некоторого внутреннего давления (иногда его называют статическим давлением). Изначально величина была учтена в общей форме в уравнении Гирна (1865): (p + π ) (V – νb) = νRT.
Ван-дер-Ваальс в 1873 г. дал функциональную интерпретацию внутреннего давления. Согласно модели Ван-дер-Ваальса, силы притяжения между молекулами (силы Ван-дер-Ваальса) обратно пропорциональны шестой степени расстояния между ними, или второй степени объема, занимаемого газом. Считается также, что силы притяжения суммируются с внешним давлением. С учетом этих соображений уравнение состояния идеального газа преобразуется в уравнение Ван-дер-Ваальса:
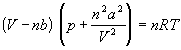
Перепишем это уравнение так, чтобы выразить объем: ![]()
Это уравнение содержит объем в третьей степени и, следовательно, имеет или три действительных корня, или один действительный и два мнимых. При высоких температурах оно имеет один действительный корень, и по мере повышения температуры кривые, вычисленные по уравнению Ван-дер-Ваальса, приближаются к гиперболам, соответствующим уравнению состояния идеального газа.
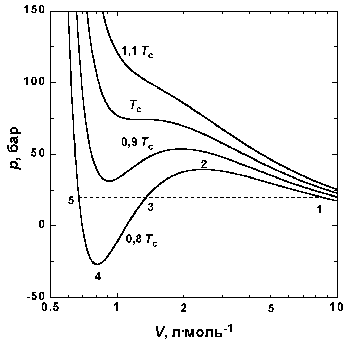
Рис.1.4 Изотермы Ван-дер-Ваальса для СО2
На рис. 1.4 приведены изотермы, вычисленные по уравнению Ван-дер-Ваальса для диоксида углерода. Из рисунка видно, что при температурах ниже критической (31,04 °С) вместо горизонтальных прямых, соответствующих равновесию жидкости и пара, получаются волнообразные кривые 12345 с тремя действительными корнями, из которых только два, 1 и 5, физически осуществимы. Третий корень (точка 3) физически не реален, поскольку находится на участке кривой 234, противоречащем условию стабильности термодинамической системы. Состояния на участках 12 и 54, которые соответствуют переохлажденному пару и перегретой жидкости, соответственно, являются неустойчивыми (метастабильными) и могут быть лишь частично реализуемы в специальных условиях. Так, осторожно сжимая пар выше точки 1 (рис. 1.4), можно подняться по кривой 12. Для этого необходимо отсутствие в паре центров конденсации, и в первую очередь пыли. В этом случае пар оказывается в пересыщенном, т.е. переохлажденном состоянии. И наоборот, образованию капелек жидкости в таком паре способствуют, например, попадающие в него ионы. Это свойство пересыщенного пара используется в известной камере Вильсона (1912), применяемой для регистрации заряженных частиц. Движущаяся заряженная частица, попадая в камеру, содержащую пересыщенный пар, и соударяясь с молекулами, образует на своем пути ионы, создающие туманный след – трек, который фиксируется фотографически.
Согласно правилу Максвелла (the Maxwell construction), которое имеет теоретическое обоснование, для того, чтобы расчетная кривая соответствовала экспериментальной равновесной изотерме, нужно вместо кривой 12345 провести горизонтальную прямую 15 так, чтобы площади 1231 и 3453 были равны. Тогда ордината прямой 15 будет равна давлению насыщенного пара, а абсциссы точек 1 и 5 – мольным объемам пара и жидкости при данной температуре.
По мере повышения температуры все три корня сближаются, и при критической температуре Tc все три корня становятся равными. В критической точке изотерма Ван-дер-Ваальса имеет точку перегиба 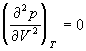 с горизонтальной касательной
с горизонтальной касательной ![]() , то есть
, то есть 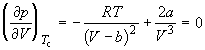 и
и 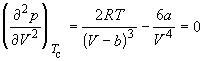 .
.
 Вблизи поверхности Земли ускорение свободного падения зависит ОТ широты местности. Это объясняется нешарообразностью формы Земли и влиянием суточного вращения Земли вокруг своей оси.
Вблизи поверхности Земли ускорение свободного падения зависит ОТ широты местности. Это объясняется нешарообразностью формы Земли и влиянием суточного вращения Земли вокруг своей оси.
 Законы физики основаны на фактах, установленных опытным путем.
Законы физики основаны на фактах, установленных опытным путем.
 Турбина 16 века использовавшая энергию движущейся воды, применялась для привода ирригационных насосов.
Турбина 16 века использовавшая энергию движущейся воды, применялась для привода ирригационных насосов.