Как известно, уравнение состояния устанавливает функциональную связь между давлением p, объемом V, температурой T и числом молей n газа в состоянии равновесия. Эта связь может выражаться не только в форме уравнения, но также графически или в виде таблиц, которые часто используются, особенно для практических целей. Самым простым и известным уравнением состояния является уравнение состояния идеального газа:
pV = nRT, где R – универсальная газовая постоянная.
Реальные газы описываются уравнением состояния идеального газа только приближенно, и отклонения от идеального поведения становятся заметными при высоких давлениях и низких температурах, особенно когда газ близок к конденсации.
Так, для газов с низкой температурой сжижения (He, H2, Ne и даже N2, O2, Ar, CO, CH4) при давлениях до 50 атм отклонения не превышают 5%, а при давлениях до 10 атм – 2%. Легко конденсирующиеся газы (CO2, SO2, Cl2, CH3Cl) уже при 1 атм обнаруживают отклонения до 2 – 3%.
Одной из наглядных характеристик отклонений реальных газов от идеального поведения оказывается мольный объем газа Vm = V/n. Для идеального газа он равен 22,414 л при 1 атм и 273 K. Наиболее удобной мерой неидеальности является фактор сжимаемости Z = pVm/RT, поскольку для идеального газа Z = l при любых условиях.
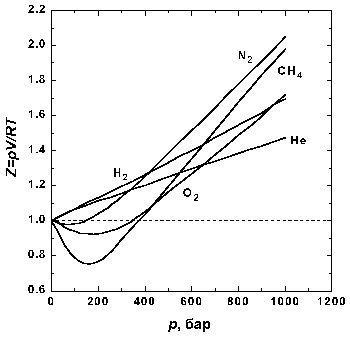
Рис.1.1 Зависимость фактора сжимаемости некоторых газов от давления при 298 К.
На рис. 1.1 представлены факторы сжимаемости для некоторых реальных газов как функции давления при 298 К (для сравнения поведение идеального газа показано пунктиром). При высоких давлениях для всех газов Z > 1, т.е. их труднее сжать, чем идеальный газ, поскольку в этой области преобладают силы межмолекулярного отталкивания. Из рисунка видно, что при более низких давлениях для некоторых газов Z < 1, что объясняется преобладанием межмолекулярного притяжения. При p → 0 эффект межмолекулярного притяжения исчезает, потому что расстояние между молекулами стремится к бесконечности, и для всех газов Z → 1, т.е. в этих условиях все газы ведут себя почти идеально.
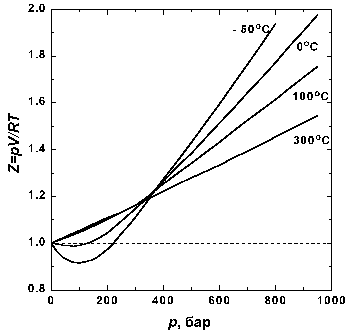
Рис 1.2. Зависимость фактора сжимаемости N2 от давления при разных температурах.
На рис. 1.2 представлены факторы сжимаемости для азота при разных температурах. По мере уменьшения температуры эффект межмолекулярного притяжения увеличивается (что проявляется в образовании минимума на кривых в области давлений около 100 бар). Минимум на кривых обнаруживается для всех газов, если температура достаточно низка. У водорода и гелия, имеющих очень низкие температуры кипения, этот минимум наблюдается только при температурах значительно ниже 0° C.
Из приведенных данных видно, что при низких давлениях реальные газы могут быть более сжимаемыми (Z < 1), чем идеальный газ, а при высоких – менее (Z > 1). Очевидно, что основными причинами отклонений свойств реальных газов от свойств идеального газа оказываются взаимное притяжение молекул и наличие у них собственного объема. Наиболее ярко межмолекулярное притяжение в реальных газах проявляется в их способности к конденсации – переходу в жидкое состояние.
 Вблизи поверхности Земли ускорение свободного падения зависит ОТ широты местности. Это объясняется нешарообразностью формы Земли и влиянием суточного вращения Земли вокруг своей оси.
Вблизи поверхности Земли ускорение свободного падения зависит ОТ широты местности. Это объясняется нешарообразностью формы Земли и влиянием суточного вращения Земли вокруг своей оси.
 Законы физики основаны на фактах, установленных опытным путем.
Законы физики основаны на фактах, установленных опытным путем.
 Турбина 16 века использовавшая энергию движущейся воды, применялась для привода ирригационных насосов.
Турбина 16 века использовавшая энергию движущейся воды, применялась для привода ирригационных насосов.